(Người Chăn Nuôi) – Thách thức lớn nhất ở thời điểm hiện tại được người chăn nuôi quan tâm là hai dịch bệnh nguy hiểm: Dịch tả heo Châu Phi (ASF) và Hội chứng rối loạn hô hấp và sinh sản (PRRS). Đây là hai mầm bệnh có đặc điểm dịch tễ phức tạp, tỷ lệ bệnh/chết cao, khả năng gây suy giảm miễn dịch cấp tính và gây ảnh hưởng lớn đến năng suất chăn nuôi heo. Trong bối cảnh lưu hành trên diện rộng của ASF và PRRS với hậu quả nghiêm trọng, sự kiểm soát hiệu quả hai dịch bệnh này là một vấn đề then chốt, cần được chỉ ra để giúp người chăn nuôi an tâm và đảm bảo sự ổn định tiến đến phát triển đàn heo bền vững.
-
Dịch tả heo Châu Phi – sự biến đổi độc lực và tác động
ASFV thuộc họ Asfarviridae, là virus DNA sợi kép có cấu trúc phức tạp, lây truyền chủ yếu qua tiếp xúc trực tiếp, môi trường, thức ăn/nước uống vấy nhiễm, và đặc biệt có thể lây truyền qua vector sinh học như ve mềm Ornithodoros spp. Tùy theo độc lực của chủng virus, ASFV có thể gây ra thể bệnh quá cấp tính với tỷ lệ chết lên tới 100%, hoặc thể mãn tính với tỷ lệ chết thấp nhưng khó chẩn đoán phát hiện qua lâm sàng, nhất là ở heo nái và heo con. Ngoài ra, dấu hiệu lâm sàng và bệnh tích khi nhiễm ASFV rất đa dạng phụ thuộc vào nhiều yếu tố như tình trạng miễn dịch của vật chủ, độc lực của chủng virus nhiễm, liều tiếp xúc và đường lây nhiễm. Các thử nghiệm gây nhiễm cho thấy đường tiêm bắp và nhỏ mũi (liều cao) cho tỷ lệ mắc bệnh gần như tuyệt đối, trong khi các hình thức gây nhiễm qua thức ăn, nước uống hoặc tiếp xúc trực tiếp thường cho kết quả thấp hơn.
Sự đa dạng di truyền của ASFV là một thách thức lớn trong kiểm soát bệnh. Hiện nay, Việt Nam đã ghi nhận sự đa dạng gien của các chủng ASFV, gồm có chủng genotype II độc lực cao, chủng tái tổ hợp genotype I và genotype II, chủng genotype II độc lực thấp (ASF-GUS-Vietnam), và chủng “like-vaccine” độc lực thấp, tạo ra một sự phức tạp trong công tác chẩn đoán và cấp bách về giám sát dịch bệnh, khả năng gây bệnh và tái tổ hợp giữa các chủng mầm bệnh ASFV. Các chủng ASFV đa dạng tạo ra một sự đa dạng lâm sàng và bệnh tích gây ra trong các ổ dịch ở thực địa; trong đó, tần suất các ổ dịch không điển hình của thể cấp tính được ghi nhận phổ biến hơn ở các trang trại, bước đầu được xem là thể bán cấp tính hoặc mãn tính, có đặc điểm khó nhận biết bằng đánh giá lâm sàng mà phải chờ kết quả xét nghiệm. Chủng virus ASF độc lực thấp được người chăn nuôi đánh giá là có khả năng lây lan nhanh và cao hơn bình thường, bởi do nhiễm cận lâm sàng, lâm sàng nhẹ hoặc không rõ ràng nên khi phát hiện ra thì mầm bệnh đã âm thầm lây lan trong đàn heo ở phạm vi rộng của trại, kể cả xét nghiệm kháng nguyên mầm bệnh cũng có thể cho kết quả âm tính giả do hàm lượng virus thấp vào thời điểm thu mẫu (giá trị Ct phát hiện dương tính thường nằm ở khoảng 30 – 35).
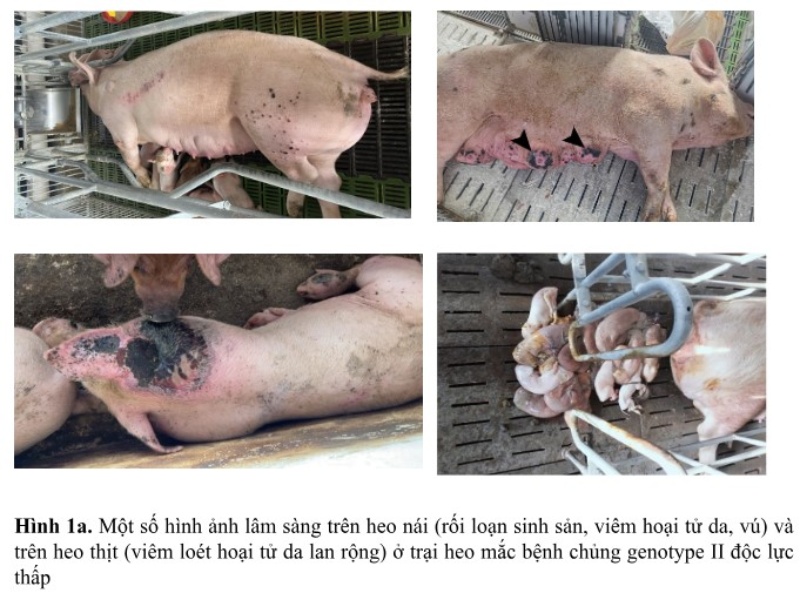
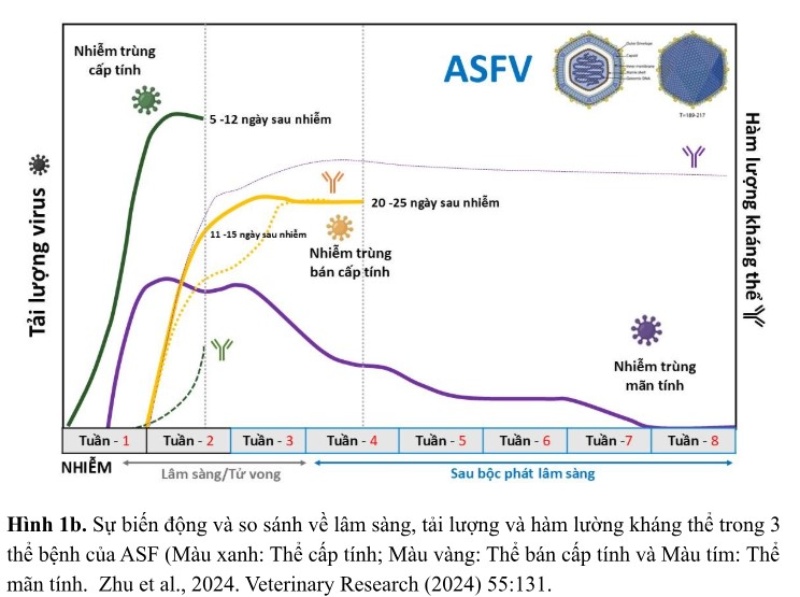
Đối phó với thực trạng đa dạng chủng nhiễm và lâm sàng, các phương pháp chẩn đoán nhanh, chính xác, nhạy cảm cao đóng vai trò quan trọng trong việc chủ động tầm soát sự lưu hành của virus trong đàn heo và ngăn chặn kịp thời sự lây nhiễm cận lâm sàng và các vấy nhiễm ở môi trường, vật chủ trung gian truyền bệnh,…để tránh việc lây lan thầm lặng ASFV nhất là các chủng độc lực thấp. Sự biến đổi của chủng genotype II tạo ra các biến thể đang lưu hành, sự xuất hiện của chủng tái tổ hợp của genotype I/II và các chủng “vaccine-like” sống nhược độc, khiến cho việc chẩn đoán trở nên khó khăn và tốn kém. Các quy trình PCR được khuyến cáo bởi (WOAH, 2023) trước đó vẫn có thể sử dụng để đánh giá sự hiện diện của ASFV nhưng không có khả năng phân biệt các kiểu gien (genotype) khác nhau và không phân biệt được chủng virus vaccine hay thực địa. Chính vì thế, sự chủ động giám sát lâm sàng, tầm soát qua xét nghiệm để chẩn đoán sớm ca nhiễm và chủng nhiễm ở trại là bước đầu tiên của biện pháp ngăn ngừa dịch bệnh, từ đó có đủ thời gian ra quyết định chọn giải pháp kiểm soát/ngăn chặn sự lây lan hiệu quả và góp phần chủ động trong công tác an toàn và an ninh sinh học của trang trại.
-
Giải pháp kiểm soát
-
Các biện pháp kiểm soát bệnh tổng thể
Sự hình thành và tồn tại của mầm bệnh truyền nhiễm được mô tả ở vòng truyền lây cơ bản, gồm các đối tượng chính là nguồn bệnh (mầm bệnh), thú cảm thụ (vật chủ) và môi trường; trong đó yếu tố truyền lây trung gian (vectors: sinh học hay phi sinh học) có vai trò quan trọng do có tính chất di động và truyền lây mầm bệnh qua lại giữa các đối tượng trong vòng truyền lây. Chính vì thế, nguyên lý của phòng bệnh truyền nhiễm là cắt đứt 1 trong 3 khâu của vòng truyền lây bệnh. Nếu muốn vật chủ không bị bệnh thì phải tạo ra sức đề kháng qua tiêm phòng chủ động. Mầm bệnh sẽ bị tiêu diệt nếu nguồn bệnh (heo mắc bệnh) được kiểm dịch, tiêu hủy hay chôn cất hợp lý. Sự vấy nhiễm mầm bệnh có thể bị loại trừ khỏi môi trường qua hoạt động vệ sinh khử trùng hoặc để lâu một thời gian ở môi trường bất lợi. Heo sống trong môi trường sạch sẽ (không mầm bệnh) thì sẽ không nhiễm mắc bệnh.
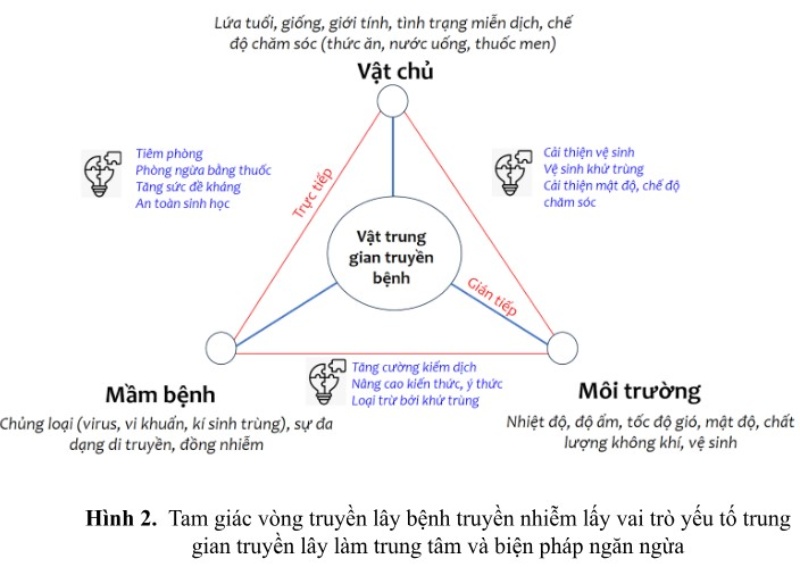
Mỗi mầm bệnh truyền nhiễm trên heo có đặc điểm sinh bệnh học khác nhau về thời gian ủ bệnh, thời điểm và con đường bài thải, tồn tại bên ngoài môi trường và cách thức lây nhiễm nên chúng ta sẽ có các biện pháp phù hợp và hiệu quả khác nhau. Các biện pháp cụ thể thường được chọn lựa áp dụng hoặc phối hợp trong kiểm soát và xử lý dịch bệnh như ở dưới đây:
Loại đàn, tái đàn
Xét nghiệm và loại heo
Cai sữa sớm, tách biệt
Đóng đàn
Tiêm phòng chủ động
Phơi nhiễm tự nhiên
Dùng thuốc (kháng sinh, interferon, …)
Trong đó, biện pháp loại đàn/tái đàn và xét nghiệm/loại heo nhắm đến loại trừ nguồn bệnh/mầm bệnh; biện pháp tiêm phòng chủ động, phơi nhiễm tự nhiên hoặc dùng thuốc tác động vào vật chủ để tạo miễn dịch chủ động hay bị động; và biện pháp di chuyển tách biệt heo đến nơi khác, cai sữa sớm/ tách biệt và đóng đàn nhắm đến đối tượng là môi trường nuôi an toàn không có mầm bệnh. Mỗi biện pháp đều có tính ưu và nhược điểm nhưng trong thực tế các mầm bệnh truyền nhiễm quan trọng trên heo có tính phức tạp nên cần chọn lựa và áp dụng phối hợp các biện pháp mới đem lại hiệu quả trong thực tế. Hiện nay, an toàn sinh học (ATSH) được xem là một chiến lược quan trọng, cần thiết và có tính bao quát và cần nhiều nguồn lực để thực hiện nên bên cạnh ATSH người quản lý an toàn dịch bệnh cần chọn kết hợp các biện pháp chuyên biệt hơn như đề cập ở trên.
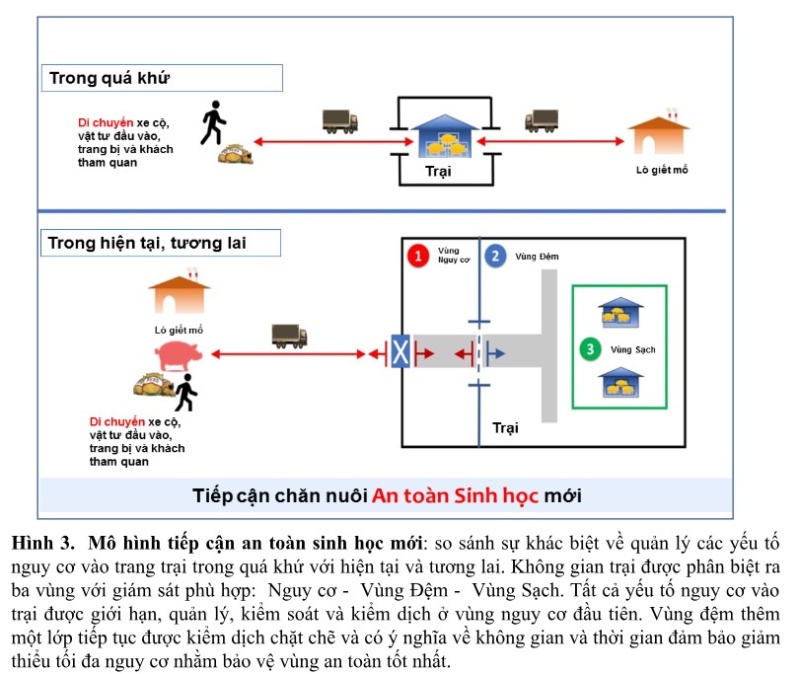
Ở “kỷ nguyên” dịch bệnh truyền nhiễm phức tạp, “chúng ta cần thiết thay đổi tự duy cũ sang tư duy mới trong chăn nuôi an toàn dịch bệnh”, tiếp cận an toàn sinh học mới. Trong tiếp cận an toàn sinh học mới, tất cả các yếu tố an toàn sinh học kể trên được xem xét, phân loại và sắp đặt vào không gian an toàn sinh học nhất định của trại (bên ngoài và bên trong). Để đạt được an toàn sinh học theo tiếp cận mới, cấu trúc (mô hình) trại cần được phân định ra thành 03 vùng an toàn sinh học khác nhau về mặt không gian (Hình 3), được đặt tên là vùng Nguy cơ, vùng Đệm và vùng Sạch; 3 vùng này ngăn cách nhau bởi các lớp hàng rào an toàn sinh học, hàng rào an toàn sinh học ngăn cách các vùng không chỉ là tường rào (phần cứng) mà còn là quy trình hoạt động của trại (phần mềm), được tái sắp xếp theo một trật tự mới. Các yếu tố nguy cơ cao từ bên ngoài sẽ được loại bỏ, ngăn chặn từ hàng rào bên ngoài hoặc chỉ cho nhập trại ở đúng vị trí nhất định (Vùng nguy cơ) và được xử lý nguy cơ triệt để. Phần lớn nguy cơ truyền nhiễm có nguồn gốc từ bên ngoài vào, nên đây là hàng rào an toàn sinh học cần được bảo vệ chặt chẽ và đầu tiên. Ở vùng nguy cơ, tất cả yếu tố nguy cơ nhập trại cần được áp dụng phân loại mức độ nguy cơ, loại bỏ hoặc xử lý triệt để sự vấy nhiễm và cần áp dụng “thời gian nghỉ tối thiểu cần thiết – empty time” để chấm dứt sự sống của mầm bệnh theo một cách tự nhiên theo thời gian; bên cạnh đó hạn chế sự tiếp xúc, nhiễm chéo và tồn lưu mầm bệnh trong các vùng của trại nuôi. Vùng Đệm là hàng rào an toàn sinh học bảo vệ thứ hai để đảm bảo các yếu tố nguy cơ được loại bỏ hoàn toàn mầm bệnh theo không gian và thời gian trước khi cho phép đi vào vùng Sạch. Vùng Sạch là vùng bảo vệ cuối cùng, có tính an toàn cao của trại chăn nuôi, tại đây hoạt động sinh trưởng và phát triển của heo được diễn ra hiệu quả.
Interferon (IFN) và vai trò sinh học
Interferon (IFNs) là các cytokine kháng virus đóng vai trò then chốt trong phản ứng miễn dịch bẩm sinh đối với các bệnh nhiễm virus. Interferon là nhóm protein thuộc hệ miễn dịch tự nhiên, được tế bào vật chủ sản xuất khi phát hiện sự xâm nhập của virus. Có ba loại chính: Interferon loại I (IFN-α, IFN-β), loại II (IFN-γ), và loại III (IFN-λ), mỗi loại có vai trò riêng trong điều hòa miễn dịch. Interferon loại I là tuyến phòng thủ đầu tiên chống virus, kích hoạt hàng loạt gien kháng virus trong tế bào, ức chế sự sao chép của virus, đồng thời hỗ trợ huy động tế bào miễn dịch tiêu diệt tế bào nhiễm bệnh. Interferon loại II tăng cường đáp ứng miễn dịch đặc hiệu, trong khi loại III hoạt động chủ yếu ở các mô biểu mô như đường hô hấp và ruột. Nhờ khả năng cản nhiễm và ngăn chặn sự phát triển và lan truyền của virus, interferon đã được ứng dụng trong phòng và điều trị các bệnh do virus trên người và động vật.
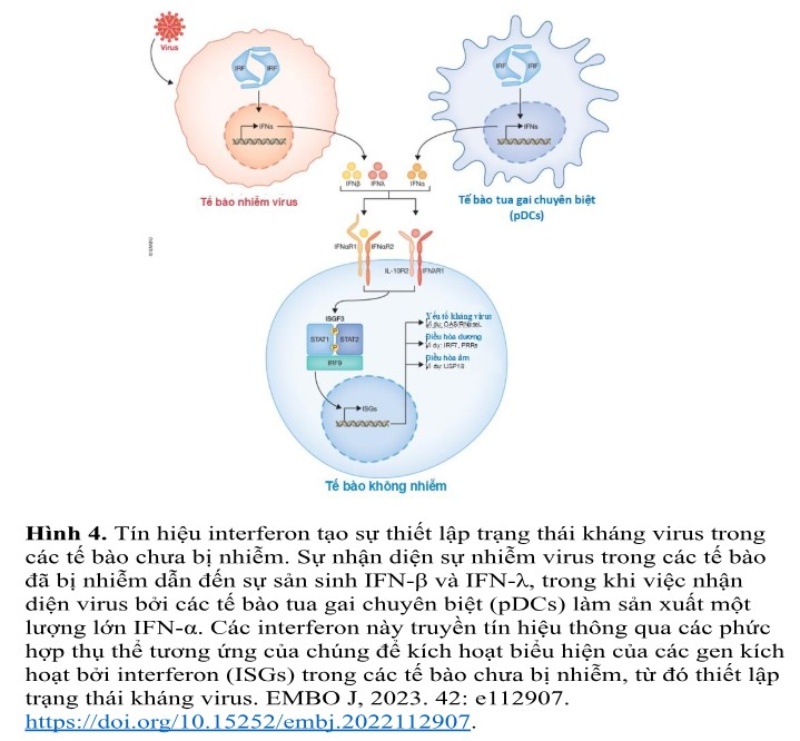
Virus xâm nhập kích hoạt IRFs trong tế bào cảm nhiễm và pDCs (plasmacytoid dendritic cell), dẫn đến tiết IFNα, IFNβ, IFNλ. Các IFNs tác động lên tế bào chưa nhiễm thông qua thụ thể IFNαR hoặc IL-10R2/IFNλR1, kích hoạt đường truyền tín hiệu JAK-STAT và hình thành phức hợp ISGF3 (STAT1, STAT2, IRF9). ISGF3 thúc đẩy phiên mã ISGs, tạo các chất hiệu quả kháng virus (antiviral effectors) (OAS, RNase L), yếu tố điều hòa dương (IRF7, PRRs), và yếu tố điều hòa âm (USP18), giúp thiết lập trạng thái kháng virus và hạn chế sự nhân lên của virus.
Tác động của ASFV lên miễn dịch bẩm sinh và khả năng của Interferon trong đáp ứng kháng virus
Virus Dịch tả heo châu Phi (ASFV) chủ yếu xâm nhập và gây ảnh hưởng đến đại thực bào và tế bào tua gai (dendritic cells – DCs), là những thành phần quan trọng trong hệ miễn dịch bẩm sinh. ASFV cũng có khả năng điều hòa biểu hiện của các thụ thể miễn dịch trên đại thực bào, bao gồm CD14, CD16 và MHC-I, từ đó làm suy giảm chức năng kháng virus và làm giảm khả năng hoạt hóa tế bào NK. Mức độ nhạy cảm với interferon của các chủng ASFV là khác nhau. Một số chủng, bao gồm cả loại độc lực cao và giảm độc lực, cho thấy nhạy cảm với IFN-α và IFN-γ, đặc biệt là trên đại thực bào phế nang heo (PAMs). Tuy nhiên, các chủng độc lực cao như Georgia 2007 không bị ức chế rõ ràng bởi IFN-α, trong khi các chủng giảm độc lực như NH/P68 lại rất nhạy cảm với IFN-α, có thể do mất các gen thuộc vùng MGF360 và MGF505. Ở đại thực bào, tác dụng của IFN-α còn phụ thuộc vào liều lượng, ở liều cao (800 U/mL), ASFV độc lực cao có thể bị ức chế bởi IFN-α. Quá trình trưởng thành của DCs dưới tác động của IFN-α làm giảm khả năng cảm nhiễm với ASFV. Interferon type I (IFN-I) đóng vai trò trung tâm trong kháng virus. Nhiều nghiên cứu cho thấy các chủng ASFV độc lực cao có xu hướng ức chế sản xuất IFN-I, còn các chủng giảm độc lực thì cảm ứng mạnh IFN-α và IFN-β. ASFV sử dụng nhiều cơ chế để ức chế sản xuất IFN. Các protein được mã hóa bởi gien thuộc MGF360 (A276R) và MGF505 (A528R) có khả năng ức chế hoạt động của IRF3 và NF-κB, dẫn đến giảm sản xuất IFN-β. Tuy nhiên, một số nghiên cứu in-vivo lại ghi nhận sự tăng biểu hiện IFN-α, IFN-β và IFN-γ trong huyết thanh heo nhiễm ASFV độc lực cao, cho thấy khả năng virus né tránh interferon phụ thuộc vào đặc điểm của tế bào đích và điều kiện vi môi trường trong cơ thể vật chủ.
Mặc dù ứng dụng IFN trong phòng trị ASFV chưa phổ biến, nhưng hiệu quả của interferon trong kiểm soát ASF là có tiềm năng. Dữ liệu in-vitro cho thấy, IFN của người và bò có thể ức chế sự nhân lên của virus, song các bằng chứng in-vivo cần được nghiên cứu nhiều hơn. Gần đây, nghiên cứu của tác giả người Trung Quốc và cộng sự chỉ ra rằng việc sử dụng kết hợp IFN-α và IFN-γ tái tổ hợp (liều 105 U/kg) giúp làm giảm tải lượng ASFV, tăng biểu hiện các gien kích hoạt bởi interferon (ISG) và cải thiện triệu chứng lâm sàng ở heo nhiễm. Tóm lại, IFN đóng vai trò then chốt trong đáp ứng miễn dịch chống ASFV, nhưng cơ chế né tránh IFN của ASFV vẫn chưa được hiểu đầy đủ. Cần thêm nhiều nghiên cứu in-vivo và in-vitro để làm rõ các con đường điều hòa IFN và phát triển chiến lược phòng chống hiệu quả. Ứng dụng IFN (I và II) trong phòng trị ASFV có tiềm năng thực tiễn, cần được xem xét đánh giá ở cả phòng thí nghiệm và trên thực địa để tìm ra ứng dụng hiệu quả cụ thể cho chủng ASFV nhiễm, mục đích phòng hoặc trị, đối tượng heo và liều lượng/đường cấp tối ưu.
Kết luận
ASF là một trong những bệnh truyền nhiễm nguy hiểm nhất ở heo hiện nay, với khả năng biến đổi đa dạng, gây hậu quả kinh tế nặng nề. Sự kết hợp đồng bộ và phù hợp các biện pháp phòng bệnh được mô tả ở phần trên là cần thiết. Ứng dụng chế phẩm có tính năng sinh học như interferon (IFN type I và II), có tiềm năng mang lại hiệu quả tốt trong các trường hợp kiểm soát nhiễm trùng virus, hỗ trợ điều trị và tăng cường hiệu quả của tiêm phòng.
Trước thực trạng bệnh truyền nhiễm mới nổi, tái nổi thường xuyên xuất hiện, tiếp tục có sự gia tăng hơn. Người chăn nuôi cần có đầu tư nhiều hơn về kiến thức, để “vá lại, tư duy lại” các lỗ hổng phòng bệnh và miễn dịch đàn. Có nhiều giải pháp phòng bệnh từ tổng thể đến cụ thể, trong đó an toàn sinh học nghiêm ngặt và theo tiếp cận mới là chìa khóa thành công chung trong kiểm soát hiệu quả các dịch bệnh từ bên ngoài và nội bộ bên trong trại.
Đỗ Tiến Duy1,2 và Ngô Thị Ngọc Trâm2
1Khoa Chăn Nuôi Thú Y, Trường Đại học Nông Lâm Tp. HCM
2Phòng thí nghiệm Y sinh Chăn nuôi (ABR Lab), Trường Đại học Nông Lâm Tp. HCM







